Expresión de los componentes del inflamasoma y su relación con los marcadores de riesgo cardiovascular en personas con infección por HIV-1
Resumen
Objetivo. Establecer si existe correlación entre la expresión de los componentes de los inflamasomas y los marcadores de riesgo cardiovascular en individuos con control de la replicación viral y en aquellos con replicación viral activa con terapia antirretroviral o sin ella.
Materiales y métodos. Se estudiaron 13 individuos con control de la replicación viral y 40 con replicación viral activa (19 sin terapia antirretroviral y 31 con terapia). Se evaluaron los marcadores clásicos de riesgo cardiovascular y se cuantificó mediante RT-PCR la expresión de los componentes de los inflamasomas (NLRP1, NLRP3, NLRC4, AIM2, ASC, IL-1β, IL-18 y caspasa-1), TLR2, TLR4, TGF-β e IL-10.
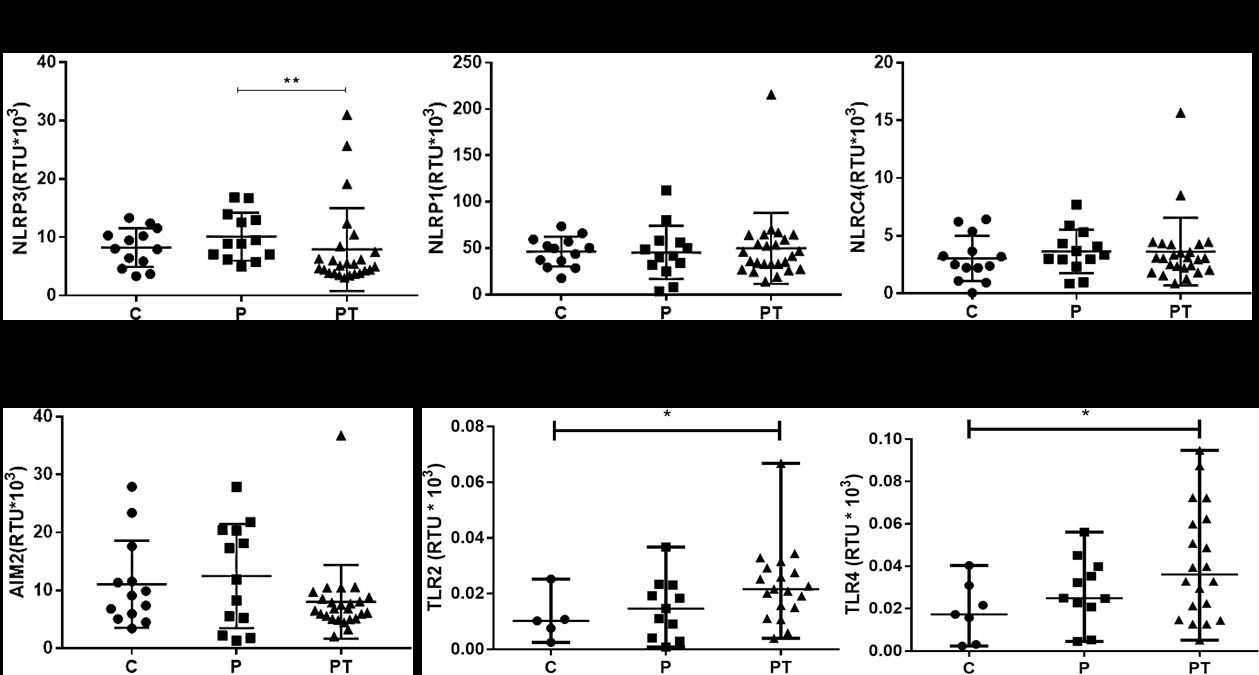
Resultados. Se observó que los pacientes con replicación viral activa y con terapia antirretroviral presentaron un incremento en la expresión de TLR2, TLR4 e IL-18, comparados con los controladores del HIV-1. Además, mostraron grandes valores de triglicéridos y lipoproteína de muy baja densidad (Very Low Density Lipopretein, VLDL), lo que se correlaciona positivamente con la expresión de los componentes de los inflamasomas NLRP1, NLRP3, NLRC4, AIM2, ASC y caspasa-1.
Conclusión. El aumento en la expresión de los componentes de los inflamasomas en los individuos con replicación viral activa y con terapia antirretroviral se correlacionó con las concentraciones de triglicéridos y VLDL, lo que sugiere el papel de la activación inmunitaria y la terapia antirretroviral en el riesgo cardiovascular.
Descargas
Referencias bibliográficas
Walker BD. Elite control of HIV Infection: Implications for vaccines and treatment. Top HIV Med. 2007;15:134-6.
Gonzalo-Gil E, Ikediobi U, Sutton RE. Mechanisms of virologic control and clinical characteristics of HIV+ elite/viremic controllers. Yale J Biol Med. 2017;90:245-59.
Deeks S, Tracy R, Douek D. Systemic effects of inflammation on health during chronic HIV infection. Immunity. 2013;39:633-45. https://doi.org/10.1016/j.immuni.2013.10.001.Systemic
Deeks S. Immune dysfunction, inflammation, and accelerated aging in patients on antiretroviral therapy. Top HIV Med. 2009;14:118-23
Lucas S, Nelson AM. HIV and the spectrum of human disease. J Pathol. 2015;235:229-41. https://doi.org/10.1002/path.4449
Kedzierska K, Crowe SM. Cytokines and HIV-1: Interactions and clinical implications. Antivir Chem Chemother. 2001;12:133-50. https://doi.org/10.1177/095632020101200301
Ahmad R, Sindhu STA, Toma E, Morisset R, Ahmad A. Elevated levels of circulating interleukin-18 in human immunodeficiency virus-infected individuals: Role of peripheral blood mononuclear cells and implications for AIDS pathogenesis. J Virol. 2002;76:12448-56. https://doi.org/10.1128/jvi.76.24.12448-12456.2002
Granowitz E V, Saget BM, Wang MZ, Dinarello CA, Skolnik PR. Interleukin 1 induces HIV-1 expression in chronically infected U1 cells: Blockade by interleukin 1 receptor antagonist and tumor necrosis factor binding protein type 1. Mol Med. 1995;1:667-77. https://doi.org/10.1007/bf03401607
Shapiro L, Puren AJ, Barton HA, Novick D, Peskind RL, Shenkar R, et al. Interleukin 18 stimulates HIV type 1 in monocytic cells. Proc Natl Acad Sci U S A. 1998;95:12550-5. https://doi.org/10.1073/pnas.95.21.12550
Swingler S, Easton A, Morris A. Cytokine augmentation of HIV-1 LTR-driven gene expression in neural cells. AIDS Res Hum Retroviruses. 1992;8:487-93. https://doi.org/10.1089/aid.1992.8.487
Martínez GJ, Celermajer DS, Patel S. The NLRP3 inflammasome and the emerging role of colchicine to inhibit atherosclerosis-associated inflammation. Atherosclerosis. 2018;269:262-71. https://doi.org/10.1016/j.atherosclerosis.2017.12.027
Mullis C, Swartz TH. NLRP3 Inflammasome signaling as a link between HIV-1 infection and atherosclerotic cardiovascular disease. Front Cardiovasc Med. 2020;7:1-11. https://doi.org/10.3389/fcvm.2020.00095
Yazdi AS, Ghoreschi K. The interleukin-1 family. Adv Exp Med Biol. 2016;941:21-9. https://doi.org/10.1007/978-94-024-0921-5
Broz P, Monack DM. Newly described pattern recognition receptors team up against intracellular pathogens. Nat Rev Immunol. 2013;13:551-65. https://doi.org/10.1038/nri3479
Hernández JC, Latz E, Urcuqui-Inchima S. HIV-1 induces the first signal to activate the NLRP3 inflammasome in monocyte-derived macrophages. Intervirology. 2014;57:36-42. https://doi.org/10.1159/000353902
Feria MG, Taborda NA, Hernández JC, Rugeles MT. HIV replication is associated to inflammasomes activation, IL-1β, IL-18 and caspase-1 expression in GALT and peripheral blood. PLoS One. 2018;13:1-14. https://doi.org/10.1371/journal.pone.0192845
Ahmad F, Mishra N, Ahrenstorf G, Franklin BS, Latz E, Schmidt RE, et al. Evidence of inflammasome activation and formation of monocyte-derived ASC specks in HIV-1 positive patients. AIDS. 2018;32:299-307. https://doi.org/10.1097/QAD.0000000000001693
Bociaga-Jasik M, Polus A, Góralska J, Śliwa A, Raź́ny U, Zdzienicka A, et al. Metabolic complications and selected cytokines in HIV-infected individuals. Pol Arch Med Wewn. 2014;124:27-35. https://doi.org/10.20452/pamw.2073
Umeh OC, Currier JS. Lipids, metabolic syndrome, and risk factors for future cardiovascular disease among HIV-infected patients. Curr HIV/AIDS Rep. 2005;2:132-9. https://doi.org/10.1007/s11904-005-0006-6
Tall AR, Yvan-Charvet L. Cholesterol, inflammation and innate immunity. Nat Rev Immunol. 2015;15:104-16. https://doi.org/10.1038/nri3793
Arias-Pérez R, Álvarez N, Sánchez-Gómez C, Flórez-Álvarez L, Marín-Palma D, Taborda NA, et al. Alteración en la expresión de proteínas transportadoras de colesterol y moléculas inmunomoduladoras en pacientes con VIH-1. Kasmera. 2021;49:1-13. https://doi.org/10.5281/zenodo.4780969
Hoseini Z, Sepahvand F, Rashidi B, Sahebkar A, Masoudifar A, Mirzaei H. NLRP3 inflammasome: Its regulation and involvement in atherosclerosis. J Cell Physiol. 2018;233:2116-32. https://doi.org/10.1002/jcp.25930
Tabares-Guevara J, Villa-Pulgarín J, Hernández JC. Atherosclerosis: Immunopathogenesis and strategies for immunotherapy. Immunotherpay. 2021;13:1. https://doi.org/10.2217/imt-2021-0009
Raposeiras-Roubín S, Triant V. Ischemic heart disease in HIV: An in-depth look at cardiovascular risk. Rev Española Cardiol. 2016;69:1204-13. https://doi.org/10.1016/j.rec.2016.10.005
Zicari S, Sessa L, Cotugno N, Ruggiero A, Morrocchi E, Concato C, et al. Immune activation, inflammation, and non-AIDS co-morbidities in HIV-infected patients under long-term ART. Viruses. 2019;11:1-19. https://doi.org/10.3390/v11030200
Marín-Palma D, Castro GA, Cardona-Arias JA, Urcuqui-Inchima S, Hernández JC. Lower high-density lipoproteins levels during human immunodeficiency virus type 1 infection are associated with increased inflammatory markers and disease progression. Front Immunol. 2018;9:1-12. https://doi.org/10.3389/fimmu.2018.01350
Marín-Palma D, Cardona-Arias JA, Hernández JC. Factores inmunológicos relacionados con VIH-1 en pacientes colombianos. Revista Ciencias de la Salud. 2019;17:245-58. https://doi.org/10.12804/revistas.urosario.edu.co/revsalud/a.7927
Schneider E, Whitmore S, Glynn KM, Domínguez K, Mitsch A, McKenna MT. et al. Revised surveillance case definitions for HIV infection among adults, adolescents, and children aged <18 months and for HIV infection and AIDS among children aged 18 months to <13 years —United States. MMWR Recomm Rep. 2008;57:1-12.
Khera AV, Cuchel M, de la Llera-Moya M, Rodrigues A, Burke MF, Jafri K, et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis. N Engl J Med. 2011;364:127-35. https://doi.org/10.1056/nejmoa1001689
Thomas MR, Lip GYH. Novel risk markers and risk assessments for cardiovascular disease. Circ Res. 2017;120:133-49. https://doi.org/10.1161/CIRCRESAHA.116.309955
Yvan-Charvet L, Bonacina F, Guinamard RR, Norata GD. Immunometabolic function of cholesterol in cardiovascular disease and beyond. Cardiovasc Res. 2019;115:1393-407. https://doi.org/10.1093/cvr/cvz127
Golia E, Limongelli G, Natale F, Fimiani F, Maddaloni V, Pariggiano I, et al. Inflammation and cardiovascular disease: From pathogenesis to therapeutic target. Curr Atheroscler Rep. 2014;16:1-7. https://doi.org/10.1007/s11883-014-0435-z
Bandera A, Masetti M, Fabbiani M, Biasin M, Muscatello A, Squillace N, et al. The NLRP3 inflammasome is upregulated in HIV-infected antiretroviral therapy-treated individuals with defective immune recovery. Front Immunol. 2018;9:1-8. https://doi.org/10.3389/fimmu.2018.00214
Toksoy A, Sennefelder H, Adam C, Hofmann S, Trautmann A, Goebeler M, et al. Potent NLRP3 inflammasome activation by the HIV reverse transcriptase inhibitor abacavir. J Biol Chem. 2017;292:2805-14. https://doi.org/10.1074/jbc.M116.749473
Luo H, He J, Qin L, Chen Y, Chen L, Li R, et al. Mycoplasma pneumoniae lipids license TLR-4 for activation of NLRP3 inflammasome and autophagy to evoke a proinflammatory response. Clin Exp Immunol. 2020;203:66-79. https://doi.org/10.1111/cei.13510
Taborda NA, Blanquiceth Y, Urcuqui-Inchima S, Latz E, Hernández JC. High-density lipoproteins decrease proinflammatory activity and modulate the innate immune response. J Interf Cytokine Res. 2019;39:760-70. https://doi.org/10.1089/jir.2019.0029
Libby P. Interleukin-1 beta as a target for atherosclerosis therapy: Biological basis of CANTOS and beyond. J Am Coll Cardiol. 2017;70:2278-89. https://doi.org/10.1016/j.jacc.2017.09.028
Rocha DM, Caldas AP, Oliveira LL, Bressan J, Hermsdorff HH. Saturated fatty acids trigger TLR4-mediated inflammatory response. Atherosclerosis. 2016;244:211-5. https://doi.org/10.1016/j.atherosclerosis.2015.11.015
Hocini H, Bonnabau H, Lacabaratz C, Lefebvre C, Tisserand P, Foucat E, et al. HIV controllers have low inflammation associated with a strong HIV-specific immune response in blood. J Virol. 2019;93:1-14. https://doi.org/10.1128/jvi.01690-18
Hileman CO, Funderburg NT. Inflammation, immune activation, and antiretroviral therapy in HIV. Curr HIV/AIDS Rep. 2017;14:93-100. https://doi.org/10.1007/s11904-017-0356-x
Hsue PY, Waters DD. HIV infection and coronary heart disease: Mechanisms and management. Nat Rev Cardiol. 2019;16:745-59. https://doi.org/10.1038/s41569-019-0219-9
Feinstein MJ, Hsue PY, Benjamin LA, Bloomfield GS, Currier JS, Freiberg MS, et al. Characteristics, prevention, and management of cardiovascular disease in people living with HIV: A scientific statement from the American Heart Association. Circulation. 2019;140:e98-124. https://doi.org/10.1161/CIR.0000000000000695
Hsue PY, Waters DD. Time to recognize HIV infection as a major cardiovascular risk factor. Circulation. 2018;138:1113-5. https://doi.org/10.1161/CIRCULATIONAHA.118.036211
Osuji FN, Onyenekwe CC, Ahaneku JE, Ukibe NR. The effects of highly active antiretroviral therapy on the serum levels of pro-inflammatory and anti-inflammatory cytokines in HIV infected subjects. J Biomed Sci. 2018;25:1-8. https://doi.org/10.1186/s12929-018-0490-9
Theron AJ, Anderson R, Rossouw TM, Steel HC. The role of transforming growth factor beta-1 in the progression of HIV/AIDS and development of Non-AIDS-defining fibrotic disorders. Front Immunol. 2017;8:1-15. https://doi.org/10.3389/fimmu.2017.01461
Orsilles MÁ, Pieri E, Cooke P, Caula C. IL-2 and IL-10 serum levels in HIV-1-infected patients with or without active antiretroviral therapy. Apmis. 2006;114:55-60. https://doi.org/10.1111/j.1600-0463.2006.apm_108.x
Girndt M, Köhler H. Interleukin-10 (IL-10): An update on its relevance for cardiovascular risk. Nephrol Dial Transplant. 2003;18:1976-9. https://doi.org/10.1093/ndt/gfg311
Lu S, Zhong J, Huang K, Zhou H. Association of IL-10-1082A/G polymorphism with cardiovascular disease risk: Evidence from a case–control study to an updated metaanalysis. Mol Genet Genomic Med. 2019;7:1-11. https://doi.org/10.1002/mgg3.888
Yilmaz MI, Solak Y, Saglam M, Cayci T, Acikel C, Unal HU, et al. The relationship between IL-10 levels and cardiovascular events in patients with CKD. Clin J Am Soc Nephrol. 2014;9:1207-16. https://doi.org/10.2215/CJN.08660813
Kaplan RC, Landay AL, Hodis HN, Gange SJ, Norris PJ, Young M, et al. Potential cardiovascular disease risk markers among HIV-infected women initiating antiretroviral treatment. J Acquir Immune Defic Syndr. 2012;60:359-68. https://doi.org/10.1097/QAI.0b013e31825b03be
Masenga S, Elijovich F, Koethe J, Hamooya B, Heimburger D, Munsaka S, et al. Hypertension and metabolic syndrome in HIV-infected patients. Curr Hypertens Rep. 2020;22:1-8. https://doi.org/https://doi.org/10.1007/s1190-020-01089-3
Ji S, Xu Y, Han D, Peng X, Lu X, Brockmeyer NH, et al. Changes in lipid indices in HIV+ cases on HAART. Biomed Res Int. 2019;2019:1-8. https://doi.org/10.1155/2019/2870647
Castro G, León K, Marín-Palma D, Oyuela S, Cataño-Bedoya JU, Duque-Botero J, et al. Evaluation of differences in metabolic and immunologic markers and cardiovascular risk in HIV-1 patients. Revista Ciencias de la Salud. 2021;19:1-18. https://doi.org/https://doi.org/10.12804/revistas.urosario.edu.co/revsalud/a
Algunos artículos similares:
- Claudia Castro, Alba Ricardo, Angie Zabaleta, Claudia Llerena, Gloria Puerto, Caracterización de aislamientos clínicos de Mycobacterium tuberculosis obtenidos de individuos positivos para HIV en Colombia, 2012 , Biomédica: Vol. 37 Núm. 1 (2017)
- Julio Cesar Martínez, Factores asociados a la mortalidad por enfermedades no transmisibles en Colombia, 2008-2012 , Biomédica: Vol. 36 Núm. 4 (2016)
- Amalia Girón-Callejas, Ricardo Mendizabal-Burastero, Elizabeth Yax, Axel Martínez, Carlos Mejía-Villatoro, Optimización de recursos para determinar la carga viral de HIV-1 en un país con pocos recursos , Biomédica: Vol. 37 Núm. 4 (2017)
- Sunny Sánchez, Dolores Zambrano, Maylen García, César Bedoya, Carlos Fernández, María Teresa Illnait-Zaragozí, Caracterización molecular de los aislamientos de Cryptococcus neoformans de pacientes con HIV, Guayaquil, Ecuador , Biomédica: Vol. 37 Núm. 3 (2017)
- Federico Rodríguez-Vega, Miguel Botero, Jorge Alberto Cortés, Ángela Tobón, Hallazgos patológicos en adenopatías de pacientes con infección por HIV , Biomédica: Vol. 37 Núm. 1 (2017)
- José Moreno-Montoya, Ana M. Barragán, Margin Martínez, Amanda Rodríguez, Ángela Carmela González, Calidad de vida y percepción de apoyo social en personas con HIV en Bogotá, Colombia , Biomédica: Vol. 38 Núm. 4 (2018)
- Catalina Arango-Ferreira, Diana Isabel Villegas, Laura Daniela Burbano, Augusto Quevedo, Calidad del seguimiento a la exposición perinatal al HIV y observancia de las estrategias reconocidas para disminuir su transmisión en un centro de referencia de Medellín , Biomédica: Vol. 39 Núm. Supl. 2 (2019): Enfermedades transmisibles en el trópico, agosto
- Juanita Camacho, Diana Moscote, Yoseth J. Ariza , HIV en mujeres mayores de 50 años. Análisis de datos administrativos en departamentos del Pacífico colombiano (2014-2018) , Biomédica: Vol. 41 Núm. Sp. 2 (2021): Octubre, Infecciones bacterianas y virales
- Marcelo Corti, María F. Villafañe , Jorge Correa , Síndrome de Ramsay-Hunt: a propósito de dos casos en que se identificó el genoma del virus de la varicela-zóster en líquido cefalorraquídeo , Biomédica: Vol. 41 Núm. 4 (2021)
- Ana María Sanín , Ángela María Londoño , Verónica Gil , Ana María Mejía , Hernán Darío Aguirre, Elsa María Vásquez , Catalina Valencia , Carolina Cardona, Manifestaciones mucocutáneas y su relación con el recuento de linfocitos T CD4 en pacientes infectados con el virus de inmunodeficiencia humana hospitalizados en Medellín, Colombia , Biomédica: Vol. 42 Núm. 2 (2022)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |
Datos de los fondos