Desarrollo y viabilidad de huevos de Toxocara canis
Resumen
Introducción. La toxocariasis es una enfermedad zoonótica transmitida por contacto con el suelo contaminado y causada principalmente por la ingestión de huevos larvados de Toxocara canis.
Objetivos. Estudiar la morfología de los estadios intraovulares en desarrollo de T. canis en cultivo, caracterizar los huevos no viables y las secuencias de las mudas larvarias, y comparar la viabilidad de los huevos en las etapas tempranas de división y al alcanzar la maduración completa.
Materiales y métodos. Se observó el desarrollo de los embriones y se caracterizaron los huevos no viables, mediante microscopía de luz. Se comparó la proporción de huevos viables con embrión con la de huevos maduros viables.
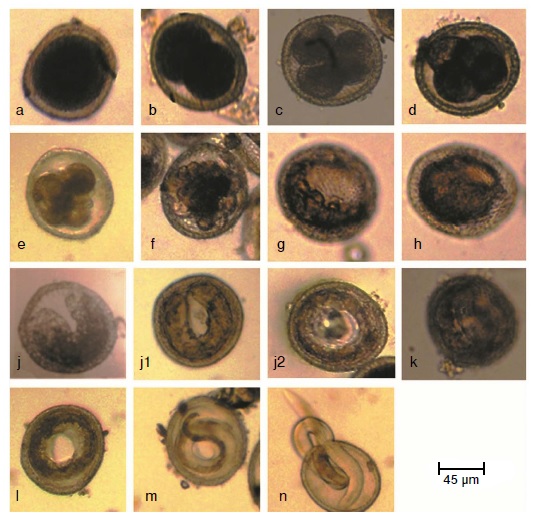
Resultados. La división celular comenzó 24 horas después de iniciado el cultivo. Los estadios tempranos estuvieron presentes por un periodo de tres a cinco días. Los estadios de desarrollo identificados fueron: huevos con una célula, con dos células, con tres células y con cuatro células; mórula temprana, mórula tardía, blástula, gástrula, renacuajo, prelarva, primer, segundo y tercer estado larvario. Se presentaron dos mudas larvarias. Los huevos no viables tenían el citoplasma degradado, cubierta exterior delgada o colapsada, y su larva no se movía al exponerla a la luz. No se encontraron diferencias significativas entre la proporción de huevos viables del día 5 al día 21, al compararla con la viabilidad de los huevos completamente maduros (30 días).
Conclusión. Los embriones en desarrollo en el medio ambiente pueden considerarse como un riesgo potencial para la salud pública. La identificación precisa de los estadios de desarrollo y la clara diferenciación de huevos viables y no viables, pueden ayudar a determinar con exactitud una tasa basal de desarrollo, la cual sería útil en el estudio de compuestos ovicidas.
Descargas
Referencias bibliográficas
Smith H, Holland C, Taylor M, Magnaval JF, Schantz P, Maizels R. How common is human toxocariasis? Towards standardizing our knowledge. Trends Parasitol. 2009;25:182-8. https://doi.org/10.1016/j.pt.2009.01.006
Moreira GM, Telmo P de L, Mendonça M, Moreira AN, McBride AJ, Scaini CJ, et al. Human toxocariasis: Current advances in diagnostics, treatment, and interventions. Trends Parasitol. 2014;30:456-64. https://doi.10.1016/j.pt.2014.07.003
Taira K, Saeed I, Permin A, Kapel CM. Zoonotic risk of Toxocara canis infection through consumption of pig or poultry viscera. Vet Parasitol. 2004;121:115-24. https://doi.org/10.1016/j.vetpar.2004.01.018
Macpherson CN. The epidemiology and public health importance of toxocariasis: A zoonosis of global importance. Int J Parasitol. 2013;43:999-1008. https://doi.org/10.1016/j.ijpara.2013.07.004
Fan CK, Liao CW, Cheng YC. Factors affecting disease manifestation of toxocarosis in humans: Genetics and environment. Vet Parasitol. 2013;193:342-52. https://doi.org/10.1016/j.vetpar.2012.12.030
Eid MM, El-Kowrany SI, Othman AA, El Gendy DI, Saied EM. Immunopathological changes in the brain of immunosuppressed mice experimentally infected with Toxocara canis. Korean J Parasitol. 2015;53:51-8. https://doi.org/10.3347/kjp.2015.53.1
Azam D, Ukpai OM, Said A, Abd-Allah GA, Morgan ER. Temperature and the development and survival of infective Toxocara canis larvae. Parasitol Res. 2012;110:649-56.
https://doi.org/10.1007/s00436-011-2536-8
Zdybel J, Cencek T, Karamon J, Kłapeć T. Effectiveness of selected stages of wastewater treatment in elimination of eggs of intestinal parasites. Bull Vet Inst Pulawy 2015;59:51-7. https://doi.org/10.1515/bvip-2015-0008
Traversa D, Frangipane di Regalbono A, Di Cesare A, La Torre F, Drake J, Pietrobelli M. Environmental contamination by canine geohelminths. Parasit Vectors. 2014;7:67. https://doi.org/10.1186/1756-3305-7-67
Kirchheimer R, Jacobs DE. Toxocara species egg contamination of soil from children’s play areas in southern England. Vet Rec. 2008;163:394-5. https://doi.org/10.1136/vr.163.13.394
Fitzgerald R, Ashley RF. Differential survival of Ascaris ova in wastewater sludge. J Water Pollut Control Fed. 1977;49:1722-4.
Morrondo P, Díez-Morrondo C, Pedreira J, Díez-Baños N, Sánchez-Andrade R, Paz-Silva A, et al.Toxocara canis larvae viability after disinfectant-exposition. Parasitol Res. 2006;99:558-61. https://doi.org/10.1007/s00436-006-0200-5
Dąbrowska J, Zdybel J, Karamon J, Kochanowski M, Stojecki K, Cencek T, et al. Assessment of viability of the nematode eggs (Ascaris, Toxocara, Trichuris) in sewage sludge with the use of LIVE/DEAD Bacterial Viability Kit. Ann Agric Environ Med. 2014;21:35-41.
Ayres RM, Mara DD. Analysis of wastewater for use in agriculture: A laboratory manual of parasitological and bacteriological techniques. Geneva: WHO; 1996. p. 1-35.
United States Environmental Protection Agency (USEPA). Control of pathogens and vector attraction in sewage sludge. Accessed: July 1st, 2003. Available from: https://www.epa.gov/sites/production/files/2015-04/documents/control_of_pathogens_and_vector_attraction_in_sewage_sludge_july_2003.pdf
Cruz LM, Allanson M, Kwa B, Azizan A, Izurieta R. Morphological changes of Ascaris spp. eggs during their development outside the host. J Parasitol. 2012;98:63-8. https://doi.org/10.1645/GE-2821.1
Onorato AR. The effects of temperature and humidity on the ova of Toxocara canis and Trichuris vulpis. Am J Hyg. 1932;16:266-87.
Brunaská M, Dubinský P, Reiterová K. Toxocara canis: Ultrastructural aspects of larval moulting in the maturing eggs. Int J Parasitol. 1995;25:683-90. https://doi.org/10.1016/0020-7519(94)00183-O
Gamboa MI. Effects of temperature and humidity on the development of eggs of Toxocara canis under laboratory conditions. J Helminthol. 2005;79:327-31. https://doi.org/10.1079/JOH2005287
Nichols RL. The etiology of visceral larva migrans. I. Diagnostic morphology of infective second-stage Toxocara larvae. J Parasitol. 1956;42:349-62.
De Savigny DH. In vitro maintenance of Toxocara canis larvae and a simple method for the production of Toxocara ES antigen for use in serodiagnostic tests for visceral larva migrans. J Parasitol. 1975;61:781-2.
El Naga IF. Toxocara canis: Determination of the origin of antigenic materials released from infective larvae. J Egypt Soc Parasitol. 2000;30:669-78.
Black MI, Scarpino PV, O’Donnell CJ, Meyer KB, Jones JV, Kaneshiro ES. Survival rates of parasite eggs in sludge during aerobic and anaerobic digestion. Appl Environ Microbiol. 1982;44:1138-43.
Johnson PW, Dixon R, Ross AD. An in-vitro test for assessing the viability of Ascaris suum eggs exposed to various sewage treatment processes. Int J Parasitol. 1998;28:627-33. https://doi.org/10.1016/S0020-7519(97)00210-5
O’Lorcain P. The effects of freezing on the viability of Toxocara canis and T. cati embryonated eggs. J Helminthol. 1995;69:169-71.
Camparoto ML, Fulan B, Colli CM, Paludo ML, Falavigna-Guilherme AL, Fernandez MA. Initial stage of development and migratory behavior of Toxocara canis larvae in BALB/c mouse experimental model. Genet Mol Res. 2008;7:444-50.
Prociv P. Intraovular development and moulting of Toxocara pteropodis. Int J Parasitol. 1989;19:749-55. https://doi.org/10.1016/0020-7519(89)90062-3
Foor WE. Ultrastructural aspects of oocyte development and shell formation in Ascaris lumbricoides. J Parasitol. 1967;53:1245-61.
Uhlikova M, Hubner J. A study on the morphology of early larval stages of Toxocara cati (Schrank, 1788). Folia Parasitol (Praha). 1982;29:165-6.
Prociv P. Observations on the morphology of Toxocara pteropodis eggs. J Helminthol. 1990;164:271-7.
Dziekońska-Rynko J, Rokicki J. Life cycle of the nematode Contracaecum rudolphii Hartwig, 1964 (sensu lato) from northern Poland under laboratory conditions. Helminthologia. 2007;44:95-102. https://doi.org/10.2478/s11687-007-0013-9
Geenen PL, Bresciani J, Boes J, Pedersen A, Eriksen L, Fagerholm HP, et al. The morphogenesis of Ascaris suum to the infective third-stage larvae within the egg. J Parasitol. 1999;85:616-22.
Overgaauw PA. Aspects of Toxocara epidemiology: Toxocarosis in dogs and cats. Crit Rev Microbiol. 1997;23:233-51. http://dx.doi.org/10.3109/10408419709115138
Kirchgässner M, Schmahl G, Al-Quraishy S, Ghaffar FA, Mehlhorn H. What are the infectious larvae in Ascaris suum and Trichuris muris? Parasitol Res. 2008;103:603-7. https://doi.org/10.1007/s00436-008-1018-0
Ooi HK, Lin CL, Wang JS. Effect of ozone treatment on Toxocara canis eggs. J. Vet Med Sci. 1998;60:169-73. https://doi.org/10.1292/jvms.60.169
Wharton D. Nematode egg-shells. Parasitology. 1980;81:447-63.
Mazurkiewicz-Zapałowicz K, Jaborowska-Jarmoluk M, Kołodziejczyk L, Kuźna-Grygiel W. Comparison of the effect of the chosenspecies of saprotrophic fungi on the development of Toxocaracanis and Ascaris suum eggs. Ann Parasitol. 2014;60:215-20.
Oksanen A, Eriksen L, Roepstorff A, Ilsøe B, Nansen P, Lind P. Embryonation and infectivity of Ascaris suum eggs: A comparison of eggs collected from worm uteri with eggs isolated from pig faeces. Acta Vet Scand. 1990;31:393-8.
Rahimian S, Gaulyb M, Das G. Embryonation ability of Ascaridia galli eggs isolated from worm uteri or host faeces. Vet Parasitol. 2016;215:29-34. https://doi.org/10.1016/j.vetpar.2015.10.026
Algunos artículos similares:
- Myriam Acero, María Mercedes Muñoz, Astrid Carolina Flórez, Rubén Santiago Nicholls, Seroprevalencia de anticuerpos contra Toxocara canis y factores de riesgo en niños, Ciudad Bolívar, Bogotá, D.C., 2000 , Biomédica: Vol. 21 Núm. 3 (2001)
- Álvaro Francisco Dulce-Villarreal, Angélica María Rojas-Bárcenas, José Danilo Jojoa-Ríos, José Fernando Gómez-Urrego, Miasis intestinal humana por Eristalis tenax en un niño de la zona urbana del municipio de Policarpa, Nariño, Colombia , Biomédica: Vol. 40 Núm. 4 (2020)
- Francy Novoa-Palomares , Laura Salas-Díaz , Cindy Pérez-Téllez , Ingred Pinillos-Medina, Orlando Torres-García, Felio J. Bello , Análisis comparativo de la actividad antimicrobiana de secreciones y excreciones larvales de Calliphora vicina y Sarconesiopsis magellanica (Diptera: Calliphoridae) , Biomédica: Vol. 42 Núm. 1 (2022)
- Patricia Betancourth, Jairo Gómez, Jorge A. Fernández-Silva , Juliana González , Parásitos anisákidos en filetes de pescado congelado destinados a consumo humano , Biomédica: Vol. 42 Núm. 4 (2022)
- Sergio Méndez-Cardona, María Cristina Carrasquilla , Camila González , Erika Santamaría , Quetotaxia del cuarto estadio larval de Pintomyia longiflocosa, vector primario de leishmaniasis cutánea en Colombia , Biomédica: Vol. 44 Núm. 4 (2024)
- Manuel Calvopina, Elías Guamán-Charco , Jasmín Vélez , Belén Vélez , Camila González , Síndrome cutáneo-hemorrágico por contacto con orugas de Lonomia spp.: primer reporte de la Amazonía ecuatoriana , Biomédica: Vol. 45 Núm. 3 (2025)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |